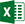Валидация Компьютерных Систем (КС) - GAMP 5
Валидация Компьютерных Систем (КС) - GAMP 5
GAMP 5
Концепция для компьютеризованных систем на основе оценки рисков в соответствии со стандартом GMP (Надлежащая производственная практика)
1. Вступление
Руководство GAMP стремится к достижению эффективным образом компьютезированных систем, являющимися пригодными для предусмотренного назначения и соответствующие нормативным требованиям, основанных на существующей надлежащей производственной практике. GAMP предлагает практическое руководство, которое:
- облегчает толкование нормативных требований
- вводит общий язык и терминологию
- способствует подходу жизненного цикла системы, основанной на надлежащей практике
- уточняет роли и обязанности
Они не являются уставом или стандартами, но обеспечивают прагматическую инструкцию, методы и инструменты для практикующих. Применяя его со знанием дела и здравым смыслом, это руководство обеспечивает надежный, экономически эффективный подход. Процедуры, описанные в данном документе, предназначены, чтобы быть совместимым с широким спектром других моделей, методов и схем, в том числе:
- Стандарты системы качества, такие как Институт инженеров по электротехнике и радиоэлектронике (IEEE), а также стандарты сертификации, такие как Международная организация по стандартизации (ISO) серии 9000
- Структуры для оценки и совершенствования возможностей и зрелости организации, такие как Capability Maturity Model lntegration® (CMMI), интеграция модели зрелости возможностей создания программного обеспечения
- Модели процесса разработки, такие как различные спиральные модели или ISO 12207
- Методы разработки программного обеспечения, такие как быстрая разработка приложений (RAD), гибкая методология разработки, методология разработки программного обеспечения® , созданная компанией Rational Software (RUP), или экстремальное программирование (XP)
- Подходы для услуг по управлению ИТ , такие как IT Infrastructure Library® (ITIL), библиотека инфраструктуры информационных технологий
По возможности терминология согласуется с международными источниками по стандартизации, таких как Международная конференция по гармонизации технических требований для регистрации лекарственных средств, используемых человеком (ICH) и ISO. Это руководство стремится быть совместимым с моделью (ASTM) E2500 (Американское общество по испытаниям и материалам) Стандартное руководство по спецификации, проектирования и верификации фармацевтической и производственных систем биофармацевтических и оборудования. GAMP является ISPE-сообществом практики. Более подробную информацию можно найти в разделе www.ispe.org.
1.1 Основания для GAMP 5
Этот выпуск инструкции GAMP был повторно обработан и согласован с новыми конспектами а также с терминологией новых нормативных и промышленных развитий. Этими являются:
- Руководство ICH Q8, Q9, а также предстоящий Q10: Формирование ожиданий для применения знаний и риск-ориентированного подхода для разработки и производства лекарственных средств, поддерживаемое фармацевтическими системами контроля
- реализация жизненного цикла качества продукции (Product Quality Lifecycle lmplementation (PQLI)): инициатива, запущенная организацией ISPE в качестве поддержки для реализации руководства ICH
- Управление по санитарному надзору за качеством пищевых продуктов и медикаментов в США (FDA): Текущая надлежащая производственная практика (cGMPs) в 21 веке Инициатива и соответствующие инструкции: Продвижение управления рисками, основанное на знаниях
- Схема сотрудничества фармацевтических проверок (PIC/S) Руководство по надлежащей практике для компьютеризированных систем в регулируемой среде GxP: разъяснение нормативных ожиданий
- Новые отраслевые стандарты, такиe, как те, которые были созданы ASTM E55-Комитетом , развивают знание процессов, их управление и возможность для разработки и производства лекарственных средств
Это нормативное и промышленное развитие сосредотачиет внимание на безопасности пациентов, качества продукции и целостности данных. Таковы основные причины для этого руководства. Кроме того, существует необходимость:
- Стремление избежать дублирования деятельности (например, при помощи полной интеграции инженерно-технических мероприятий и проектирования компьютерных систем, так что бы они выполнялись однократно)
- Использование деятельности поставщика до максимально возможной степени, при одновременном сохранении профессиональной пригодности для предусмотренного назначения
- Масштабирование (адаптация) всех этапов жизненного цикла и связанной с ними документации с учетом рисков, сложности и новшества
- Нужно отметить, что на сегодняшний день большинство компьютерных систем основываются на конфигурируемых пакетах, многие из них объединены в сеть
- Допущение того, что традиционные линейные или каскадные модели развития не во всех случаях являются наиболее подходящими
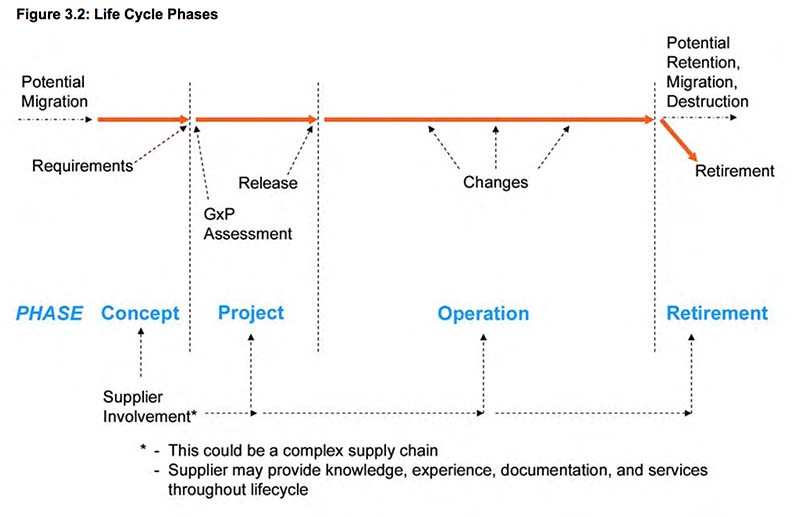
Эти нормативное и промышленное развитие и ожидания приводят к причинам, которые показаны на рис. 1.1.
1.2 Новые и пересмотренные материалы
Руководство уделяет особое внимание предоставлению экономного подхода к нормативным требованиям и свидетельству пригодности по назначению. В подтверждение этому, разрабатываются новые и актуальные инструкции:
- целостный подход жизненного цикла системы как часть системы управления качеством, от концепции до вывода из эксплуатации
- масштабируемый образ действий для достижения и поддержания GXP -конформности, движимый новшеством, сложностью и риском для безопасности пациентов, качества продукции и целостности данных
- Уточнение роли блока качества и внедрения ролям владельца процесса, владельца системы и специалистов по области
- Ударение на важность четких требований в среде GMP, основанных на глубоком понимании научного фона и критических показателей качества (CQA) в и препарата, для облегчённого вступления в концепцию "Quality by Design"
- эффективное использование документации и знаний поставщика, всякий раз, когда это возможно, во избежании ненужных дубликатов
- Улучшение эффективности путем поощрения практической и эффективной интерпретации инструкций GAMP
- Максимальное использование документации мероприятий, таких как подготовку и ввод в эксплуатацию, в качестве доказательства верификации
- Важность эффективного управления предприятием в целях достижения соответствия нормативных требований и сохранения этих
- Распознавание возможности технологических и системных улучшений на основе периодического медицинского осмотра, фундаментального анализа и корректирующих и предупреждающих действий (англ. САРА)
Новая информация будет предоставлена в конкретных приложениях для следующих особых тем промышленности:
- Регулировка с ASTM E2500
- организационные изменения
- аутсорсинг
- электронная регистрация партий
- прикладное программное обеспечение для конечных пользователей , включая таблицы и небольшие базы данных
- патч-управление
Обобщая можно сказать, что это руководство было обновлено в целях адаптации к изменяющимся условиям, при этом до момента появления руководства продолжая соответствовать действующим международнарым GMP-нормативных ожиданиям. Это руководство на момент публикации представляет собой промышленную надлежащую практику и остаётся совместимым с принципами, изложенными в GAMP 4. Область применения была расширена, для удовлетворения смежным отраслей и их поставщиков, включая биотехнологию и системы, которые используются для изготовления медицинских препаратов (компьютерные программы, возможно присутствующие при изготовлении медицинских препаратах исключены).
1.3 Назначение
Целью данного руководства является обеспечение экономически эффективной основы надлежащей практики, для установления того что автоматизированные системы являются пригодными для назначения и соответствуют применяемым инструкциям. Рамки руководства ориентированы на защиту безопасности пациентов, качества продукции и целостности данных, а так же одновременно пользу для бизнеса. Для поставщиков в отрасли науки о жизни это руководство предлагает указания по разработке и эксплуатации систем, следуя надлежащей практике. Безопасность пациентов зависит от целостности критический учётных записей, данных и решений, равным образом как эти аспекты влияют на физические характеристики продукта. Фраза "безопасность пациентов, качество продукции и целостность данных" используется в данном документе, чтобы подчеркнуть эту точку зрения. Руководство предназначено для использования регулируемыми компаниями, поставщиками и инспекторами. Что касается регулируемых компаний, то в них внутренние и внешние инстанции, предлагающие услуги, секторы программного обеспечения, аппаратных средств, оборудования, услуг по системной интеграции и услуги ИТ-поддержки, считаются поставщиками. Это руководство предназначено для широкого спектра отраслей и обязанностей, в том числе:
- руководство организации
- отдел блок качества
- отдел исследования
- отдел развития
- производственный отдел
- лаборатория (контроль качества)
- инженерный отдел
- ИТ-отдел
- вспомогательный персонал (обслуживающий персонал)
- все назначенные поставщики
Документация GAMP является руководством, а не стандартом. Ответственность за установление принципов и процедур, для удовлетворения нормативных требований возлагается на регулируемую организацию. Следовательно о поставщиках или продуктах нельзя сказать, что они руководством GAMP сертифицированы, протестированы или ему конформны.